搜索


近日,EON体育4平台微生物代謝全國重點實驗室鄭艦艇課題組在《Nature Communications》上發表題為“Filamentation activates bacterial Avs5 antiviral protein”的研究論文。該研究系統解析了細菌抗病毒蛋白EfAvs5的結構和功能🚶🏻♂️➡️,揭示其通過獨特的纖維化組裝激活NADase活性的防禦策略。EON体育4平台博士研究生王逸群為第一作者😨,鄭艦艇副教授為通訊作者。
細菌與噬菌體的持續對抗推動了細菌抗病毒防禦系統的演化。本文研究的細菌抗病毒EfAvs5(來自Escherichia fergusonii)屬於Avs(antiviral STAND)家族成員,與廣泛存在於動植物免疫系統中的核苷酸結合寡聚化結構域(NOD)樣受體(NLRs)具有進化關聯🤌🏼。EfAvs5包含三個功能模塊:SIR2效應域、中央NOD及C端感應域,賦予其抵禦多種噬菌體入侵的能力。盡管已有研究報道了SIR2蛋白與STAND家族受體在原核與真核生物免疫系統中的功能🤵🏼♀️,但其協同作用的分子機製仍不明確🤺。
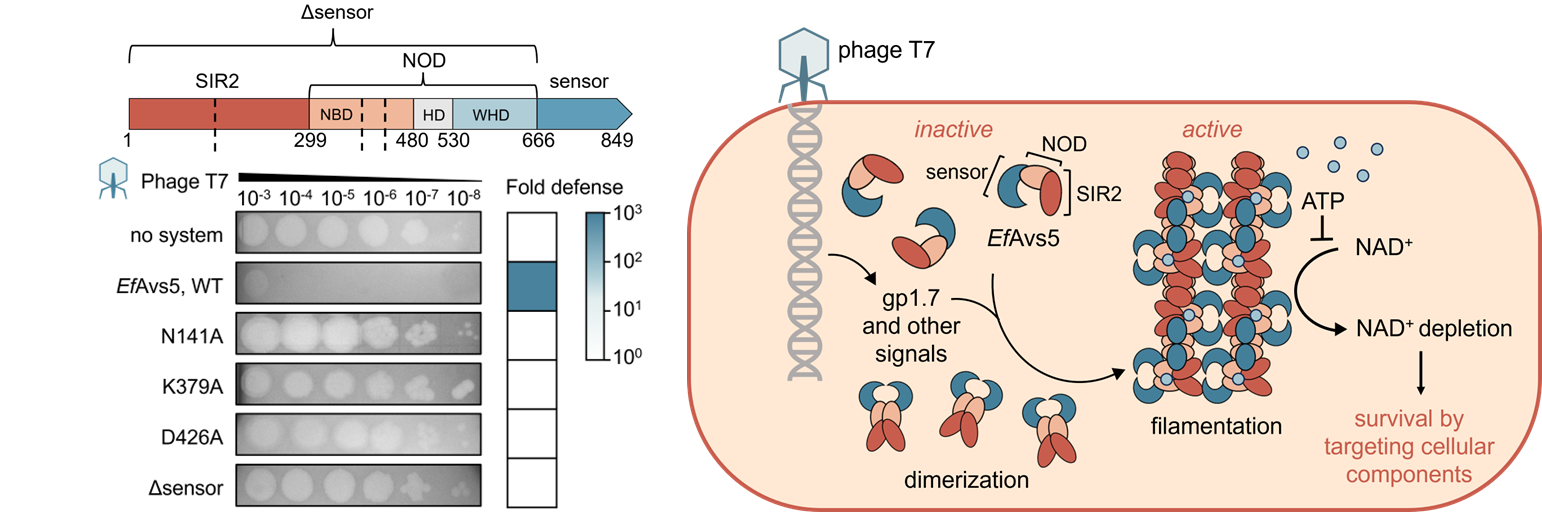
圖1.EfAvs5的抗噬菌體功能
研究證明了EfAvs5通過SIR2降解胞內NAD⁺觸發抗病毒防禦,其功能依賴於NOD結構域的ATP結合能力及C端感應域的構象完整性🛳。進一步發現,僅有形成纖維簇的EfAvs5才表現出顯著NADase活性,單體形式則完全無NADase活性。本研究進一步通過冷凍電鏡技術解析了EfAvs5纖維的高分辨率結構,揭示了其獨特的多層次組裝模式🏃♂️➡️。EfAvs5通過WHD-NBD鹽橋及SIR2-SIR2氫鍵形成C2對稱同源二聚體,二聚體間進一步通過螺旋對稱排列組裝為纖維核心。EfAvs5的纖維化組裝是由SIR2與NOD協同驅動的,這與此前報道的SIR2介導纖維組裝模式不同🏵。C端感應域通過靜電相互作用與相鄰纖維的SIR2結構域頭尾相接,驅動了纖維簇的形成,賦予結構額外的穩定性。纖維化誘導SIR2二聚體界面重構,穩定了催化構象。突變分析證明了二聚體形成🫗、單纖維形成和纖維簇形成對於EfAvs5的抗噬菌體功能都是必須的。
.png)
圖2. EfAvs5的纖維結構
免疫共沉澱-質譜聯用與生化分析揭示噬菌體T7編碼的核苷酸激酶gp1.7誘導EfAvs5形成纖維簇,激活其NAD⁺水解酶活性🧘🏿♂️,進而顯著增強細胞毒性,提示該蛋白可能作為噬菌體的“病原體相關分子模式”被免疫系統感知。另外,EfAvs5作為缺乏ATP水解活性的STAND蛋白,其抗噬菌體功能依賴於NOD結構域對ATP的結合,ATP結合可能通過穩定NOD的寡聚化構象促進EfAvs5纖維組裝;然而🧏🏿,ATP的過量積累可非競爭性抑製其NADase活性。這種動態調控模式體現了細菌免疫系統在能量代謝與防禦反應間的精密平衡💳🙅🏽♀️。
本文結合了結構生物學🕙、生物化學及微生物學等手段🧝🏻,揭示EfAvs5通過纖維化構象重構實現NADase活性精準調控的抗噬菌體新機製,闡釋超分子組裝在跨生命形式免疫信號傳導中的保守作用,並為理解噬菌體-宿主互作的分子博弈提供了新視角。
本項目得到了國家重點研發計劃和國家自然科學基金的資助。感謝國家蛋白質科學中心、EON体育4分析測試中心的技術支撐。
論文鏈接😅: https://doi.org/10.1038/s41467-025-57732-7


 首頁
首頁

 EON4概況
EON4概況

 師資隊伍
師資隊伍

 人才培養
人才培養

 招生就業
招生就業

 科學研究
科學研究

 平臺基地
平臺基地

 黨群工作
黨群工作

 校友之家
校友之家

 安全工作
安全工作

 網上辦事
網上辦事

 當前位置:
當前位置: